吴德沛教授课题组发现树突状细胞来源的IL-27 p28在急性移植物抗宿主病中起重要作用
2022年9月16日,国家血液系统疾病临床医学研究中心、苏州大学附属第一医院、造血干细胞移植研究所吴德沛、徐杨教授课题组与新加坡国立大学刘海燕教授合作在Signal Transduction and Targeted Therapy(IF=38.1)在线发表了题为“Dendritic cell-derived IL-27 p28 regulates T cell program in pathogenicity and alleviates acute graft-versus-host disease”的最新研究成果,报道了DC来源的IL-27 p28通过调节T细胞程序的致病性减轻异基因造血干细胞移植后急性移植物抗宿主病(aGVHD)的机制。

急性移植物抗宿主病(aGVHD)是异基因造血干细胞移植后的主要并发症,其特征为供体来源的T细胞与宿主内抗原呈递细胞(APCs)相互作用而引起的炎症反应和组织损伤,严重影响患者的生存和预后。在这一病理进程中,细胞因子网络对异基因反应性T细胞的致病性具有关键调控作用。靶向细胞因子的方案在aGVHD预防中已显示出较好的治疗价值。
IL-27是由EBI3和p28两个亚基组成的异二聚体,其能与IL-27Rα和gp130形成的IL-27受体相结合并通过JAK1/2和STAT1/3通路传递下游信号。IL-27由活化的APCs(包括DCs、单核、巨噬)、CX3CR1+细胞、先天类自然调节B1-a细胞等多种细胞分泌。一方面,IL-27由于其能促进NK细胞以及初始CD4+ T细胞产生IFN-γ而被首次报道。另一方面,IL-27还可以通过促进Treg、T调节型1 (Tr1)、IFN-γ+T-bet+Foxp3−Th1、Th2和Th17细胞中IL-10的释放发挥免疫抑制作用。IL-27的来源及其在aGVHD中发挥的作用目前都尚不明确。
在本研究中,研究者通过aGVHD患者外周血及小鼠动物模型检测发现IL-27 p28主要由DC细胞分泌。利用IL-27 p28条件性敲除小鼠,证明了DC来源的IL-27 p28缺乏导致Treg细胞功能受损,效应T细胞应答增强,加重小鼠aGVHD的发生发展。此外,通过scRNA-seq测序发现,IL-27 p28敲除后胸腺细胞DP阶段发育受损,抑制Treg细胞的生成,并促进IL1R2+TIGIT+致病性CD4+ T细胞。在IL-27 p28缺陷的Treg细胞中,协调Treg细胞发育的关键基因Id3、Satb1、Foxp1、Klf2和Bach2等表达降低。而在Tconv中Il1r2、Tigit、Pdcd1、Lag3、Batf、Bhlhe40以及Nr4a1等表达上调。在移植后小鼠及aGVHD患者外周血中均发现IL1R2+TIGIT+CD4+ T细胞比例显著升高。IL-27 p28敲除促进STAT1磷酸化,抑制Treg细胞分化和功能,增强Th1细胞免疫应答。IL-27 p28缺陷的Treg细胞过继输注无法有效控制aGVHD疾病进展。另外,血清中IL-27 p28表达水平高的患者其II-IV级aGVHD的发生率显著降低。
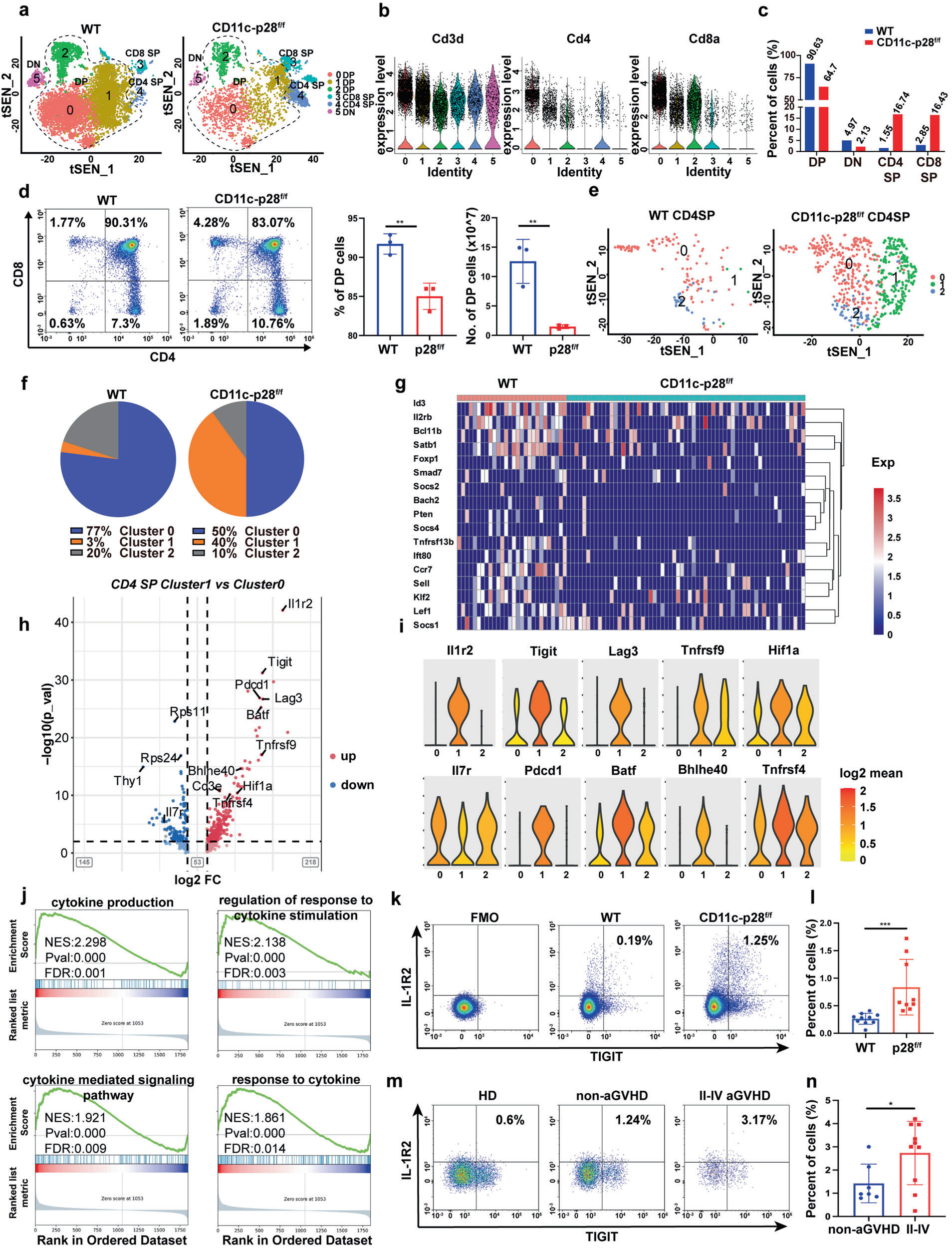
IL-27 p28敲除抑制Treg细胞分化,促进致病性IL1R2+TIGIT+CD4+ T细胞
综上所述,本研究揭示了DC来源的IL-27 p28通过调节T细胞发育过程中Treg/Teff细胞平衡抑制aGVHD的机制。IL-27 p28表达对预测临床移植后aGVHD发生具有重要的诊断价值。本研究的结果为aGVHD防治提供了一个潜在的新策略。
国家血液系统疾病临床医学研究中心、苏州大学附属第一医院、苏州大学造血干细胞移植研究所吴德沛教授、徐杨教授、马守宝教授以及新加坡国立大学刘海燕教授为本文的共同通讯作者。本课题还得到了澳大利亚昆士兰大学Di Yu教授、山东省科学院孙宏健博士、暨南大学尹芝南教授等的大力支持。该研究得到国家自然科学基金委、科技部、国家血液系统疾病临床医学研究中心、江苏省科技厅等多个科研资金的支持。
原文摘要:Interleukin 27 (IL-27), a heterodimeric cytokine composed of Epstein-Barr virus-induced 3 and p28, is a pleiotropic cytokine with both pro-and anti-inflammatory properties. However, the precise role of IL-27 in acute graft-versus-host disease is not yet fully understood. In this study, utilizing mice with IL-27 p28 deficiency in dendritic cells (DCs), we demonstrated that IL-27 p28 deficiency resulted in impaired Treg cell function and enhanced effector T cell responses, corresponding to aggravated aGVHD in mice. In addition, using single-cell RNA sequencing, we found that loss of IL-27 p28 impaired Treg cell generation and promoted IL-1R2+TIGIT+ pathogenic CD4+ T cells in the thymus at a steady state. Mechanistically, IL-27 p28 deficiency promoted STAT1 phosphorylation and Th1 cell responses, leading to the inhibition of Treg cell differentiation and function. Finally, patients with high levels of IL-27 p28 in serum showed a substantially decreased occurrence of grade II-IV aGVHD and more favorable overall survival than those with low levels of IL-27 p28. Thus, our results suggest a protective role of DC-derived IL-27 p28 in the pathogenesis of aGVHD through modulation of the Treg/Teff cell balance during thymic development. IL-27 p28 may be a valuable marker for predicting aGVHD development after transplantation in humans.










 您当前的位置:
您当前的位置: